مواد
پروٹان ، نیوٹران اور الیکٹران وہ تین اہم ذرات ہیں جو ایٹم کی تشکیل کرتے ہیں۔ جیسا کہ ان کے نام بتاتے ہیں ، سابقین پر مثبت معاوضے لگائے جاتے ہیں ، مؤخر الذکر کا کوئی چارج نہیں ہوتا ہے (وہ غیر جانبدار ہیں) اور تیسرے پر منفی چارج ہوتا ہے۔ الیکٹرانوں کی مقدار بہت کم ہوتی ہے ، جبکہ پروٹان اور نیوٹران تقریبا ایک جیسے ہوتے ہیں۔ آپ متواتر ٹیبل سے صرف معلومات کا استعمال کرتے ہوئے ایٹم میں سے ہر ایک کی تعداد حاصل کرسکتے ہیں۔
اقدامات
حصہ 1 کا 1: گنتی کرنے والا پروٹون ، الیکٹران اور نیوٹران
ایک متواتر ٹیبل حاصل کریں۔ یہ ایسی تصویر ہے جو عناصر کو جوہری ڈھانچے کے ذریعہ منظم کرتی ہے۔ یہ رنگوں کے لحاظ سے درجہ بندی کی گئی ہے اور ہر عنصر کو ایک ، دو یا تین حرفوں کی ایک منفرد مخفف فراہم کرتی ہے۔ دیگر معلومات میں ایٹم ماس اور نمبر شامل ہیں۔
- آپ کو وقتا فوقتا ٹیبل آن لائن یا کیمسٹری کی کتاب میں مل سکتا ہے۔
اپنے عنصر کو متواتر ٹیبل میں ڈھونڈیں۔ یہ عناصر کو جوہری تعداد کے ذریعہ منظم کرتا ہے اور ان کو تین اہم گروہوں میں تقسیم کرتا ہے: دھاتیں ، غیر دھاتیں اور دھات دھاتیں (نیم دھاتیں)۔ دیگر گروہوں میں الکالی دھاتیں ، ہالوجنز اور نوبل گیسیں شامل ہیں۔- گروپ (کالم) یا پیریڈ (قطاریں) کا استعمال ٹیبل میں عنصر کو تلاش کرنا آسان بنا سکتا ہے۔
- اگر آپ کو کوئی دوسری خصوصیات معلوم نہیں ہیں تو آپ عنصر کی علامت کو بھی تلاش کرسکتے ہیں۔
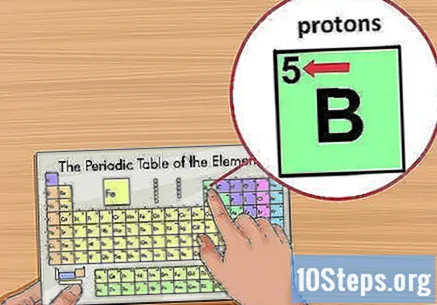
ایٹم نمبر تلاش کریں۔ یہ چوک کے اوپری بائیں کونے میں ، عنصر کی علامت کے اوپر واقع ہے۔ ایٹم نمبر آپ کو بتائے گا کہ اس عنصر کے ایک ہی ایٹم میں کتنے پروٹان بنتے ہیں۔- مثال کے طور پر ، بورن (بی) کا ایٹم نمبر 5 ہے ، اور اس وجہ سے پانچ پروٹون ہیں۔
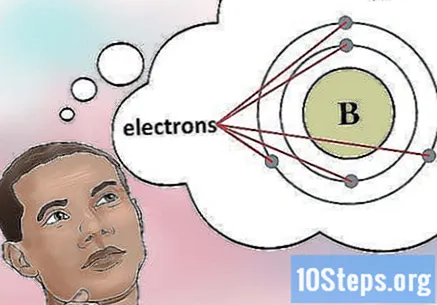
الیکٹرانوں کی تعداد کا تعین کریں۔ پروٹون ایک ایٹم کے نیوکلئس میں ایسے ذرات ہوتے ہیں جن پر مثبت چارج ہوتا ہے۔ الیکٹرانز منفی چارج ہوتے ہیں۔ لہذا ، ایک غیر جانبدار عنصر میں اتنی تعداد میں پروٹون اور الیکٹران ہوں گے۔- مثال کے طور پر ، بورن (بی) کا ایٹم نمبر 5 ہے ، اور اس وجہ سے پانچ پروٹون اور پانچ الیکٹران ہیں۔
- تاہم ، اگر عنصر میں مثبت یا منفی آئن شامل ہوں تو ، پروٹان اور الیکٹران ایک جیسے نہیں ہوں گے۔ آپ کو ان کا حساب کتاب کرنا پڑے گا۔ آئن نمبر عنصر کے بعد ایک چھوٹے سے سپر اسکرپٹ کے بطور ظاہر ہوگا۔
ایٹم ماس کی تلاش کریں۔ نیوٹران کی تعداد معلوم کرنے کے ل you ، آپ کو پہلے جوہری ماس تلاش کرنے کی ضرورت ہوگی۔ یہ قدر کسی عنصر کے ایٹموں کی اوسط تعداد ہے اور عنصر کی علامت کے نیچے پائی جاسکتی ہے۔
- جوہری ماس کو اگلی پوری تعداد میں گول کریں۔ مثال کے طور پر ، بورن کا جوہری ماس 10.811 ہے ، لیکن آپ اسے 11 تک لے سکتے ہیں۔
جوہری تعداد کو جوہری ماس سے جمع کریں۔ نیوٹران کی تعداد معلوم کرنے کے ل you ، آپ کو ایٹم نمبر کو بڑے پیمانے پر سے گھٹانے کی ضرورت ہے۔ یاد رہے کہ جوہری تعداد پروٹونوں کے برابر ہے ، جس کی شناخت پہلے ہی ہوچکی ہے۔
- ہمارے بورون مثال کے طور پر ، 11 (جوہری ماس) - 5 (جوہری تعداد) = 6 نیوٹران
حصہ 2 کا 2: موجودہ آئنوں کے ساتھ الیکٹرانوں کا حساب لگانا
آئنوں کی تعداد کی شناخت کریں۔ یہ عنصر کے بعد ایک چھوٹی سپر اسکرپٹ ویلیو کے طور پر ظاہر ہوگی۔ آئن الیکٹرانوں کے اضافے یا ہٹانے کی وجہ سے ایک مثبت یا منفی چارج والا ایٹم ہے۔ آئن میں ، اگرچہ پروٹون کی تعداد ایک ہی رہ جاتی ہے ، لیکن الیکٹرانوں کی تعداد میں بدلاؤ آتا ہے۔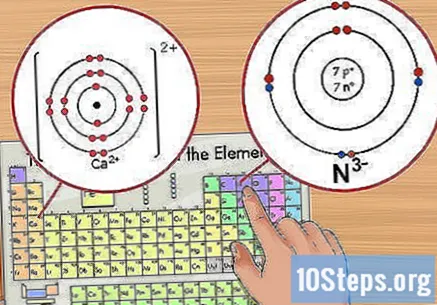
- چونکہ الیکٹران کا منفی چارج ہوتا ہے ، جب اسے ہٹا دیا جاتا ہے ، آئن مثبت ہوجاتا ہے۔ جیسا کہ زیادہ الیکٹران شامل ہوتے ہیں ، آئن منفی ہوجاتا ہے۔
- مثال کے طور پر ، N پر -3 چارج ہے ، جبکہ Ca میں +2 چارج ہے۔
- یاد رکھیں کہ اگر عنصر کے بعد کوئی سپر اسکرپٹ نمبر نہیں ہے تو آپ کو یہ حساب کتاب کرنے کی ضرورت نہیں ہے۔
جوہری تعداد سے چارج جمع کریں۔ جب آئن میں مثبت معاوضہ ہوتا ہے تو ، ایٹم کے الیکٹران کھو جاتے ہیں۔ ان میں سے باقی رقم کا حساب کتاب کرنے کے لئے ، جوہری تعداد سے اضافی معاوضے کی رقم گھٹائیں۔ مثبت آئن کی صورت میں ، الیکٹرانوں سے زیادہ پروٹونز موجود ہیں۔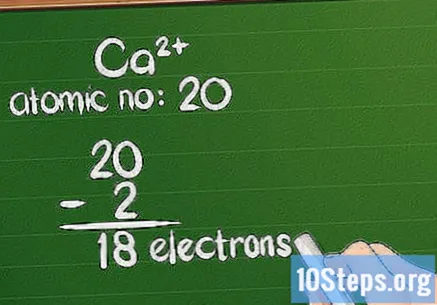
- مثال کے طور پر ، Ca پر +2 چارج ہوتا ہے ، لہذا اس نے اپنی قدرتی حالت سے 2 الیکٹرانوں کو کھو دیا ہے۔ کیلشیم کی جوہری تعداد 20 ہے ، لہذا آئن میں 18 الیکٹران ہیں۔
منفی آئنوں کے لئے جوہری تعداد میں چارج شامل کریں۔ جب آئن کا منفی چارج ہوتا ہے تو ، ایٹم نے الیکٹران حاصل کرلیا ہے۔ ان کی کل تعداد کا حساب لگانے کے ل you ، آپ صرف جوہری تعداد میں اضافی چارج کی مقدار شامل کریں گے۔ منفی آئن کی صورت میں ، الیکٹرانوں سے کم پروٹون ہوتے ہیں۔
- مثال کے طور پر ، ن پر ایک -3 چارج ہے ، لہذا جب اس کی غیر جانبدار حالت کے مقابلے میں اس نے تین الیکٹران حاصل کیے۔ نائٹروجن کی جوہری تعداد 7 ہے ، لہذا اس آئن میں 10 الیکٹران ہیں۔