مواد
اگرچہ ایک ہی عنصر کے تمام ایٹموں میں ایک ہی تعداد میں پروٹان ہوتے ہیں ، لیکن نیوٹران کی تعداد مختلف ہوسکتی ہے۔ کسی خاص ایٹم کے کتنے نیوٹران ہوتے ہیں یہ جاننے میں آپ کو یہ طے کرنے میں مدد مل سکتی ہے کہ آیا اس عنصر میں ایک ذرہ باقاعدہ ہے یا آاسوٹوپ ، جس میں کم و بیش نیوٹران ہوں گے۔ ایٹم میں نیوٹران کی تعداد کا تعین کرنا بالکل آسان ہے اور اس کے لئے کسی تجربے کی ضرورت نہیں ہے۔ مستقل ایٹم یا آاسوٹوپ میں نیوٹران کی تعداد کا حساب کتاب کرنے کے لئے ، متواتر ٹیبل کو ہاتھ میں رکھتے ہوئے ان ہدایات پر عمل کریں۔
اقدامات
طریقہ 1 میں سے 2: ایک عام ایٹم میں غیر جانبداروں کی تعداد کا پتہ لگانا
متواتر ٹیبل میں عنصر کا پتہ لگائیں۔ اس مثال کے طور پر ، آئی ایس (او ایس) پر نظر ڈالیں ، جو چھٹی صف میں ہے ، اوپر سے نیچے تک۔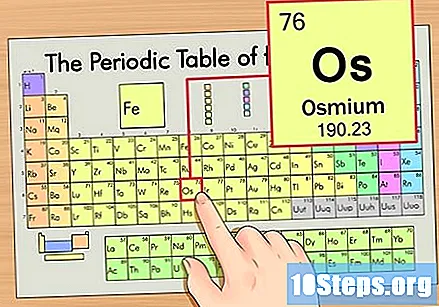
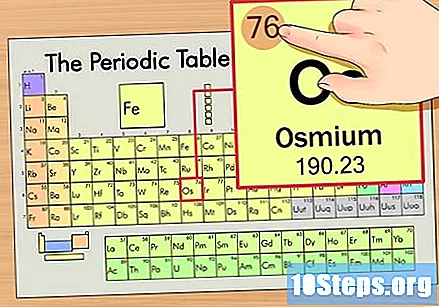
عنصر کی ایٹم نمبر تلاش کریں۔ یہ عام طور پر کسی خاص عنصر کے لئے سب سے زیادہ دکھائی دینے والی تعداد ہوتی ہے اور عام طور پر اس کی علامت سے بھی اوپر ہوتی ہے (اس جدول میں جس کا ہم استعمال کررہے ہیں ، در حقیقت ، کوئی دوسرا نمبر درج نہیں ہے)۔ جوہری تعداد اس عنصر کے ایک واحد ایٹم میں پروٹان کی تعداد ہوتی ہے. اوس کی تعداد 76 ہے ، اس کا مطلب یہ ہے کہ ایک آسیمیم ایٹم میں 76 پروٹون ہیں۔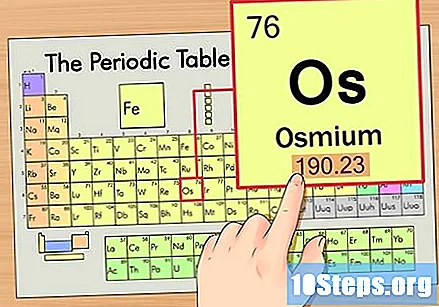
عنصر کا جوہری وزن تلاش کریں۔ یہ نمبر عام طور پر جوہری علامت کے نیچے پایا جاتا ہے۔ نوٹ کریں کہ اس مثال میں جدول صرف جوہری تعداد پر مبنی ہے اور جوہری وزن کی فہرست نہیں رکھتا ہے۔ ایسا ہمیشہ نہیں ہوگا۔ اسیمیم کا جوہری وزن 190.23 ہے۔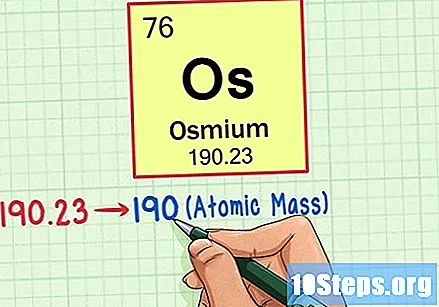
جوہری وزن کو تلاش کرنے کے لئے ایٹم کے وزن کو قریب ترین پوری تعداد میں گول کریں۔ ہماری مثال کے طور پر ، 190.23 کی گول 190 کی ہوگی ، جس کے نتیجے میں آسیمیم کے لئے 190 کا ایٹم ماس پیدا ہوگا۔- جوہری ماس عنصر کے آاسوٹوپس کی اوسط ہے۔ لہذا ، یہ عام طور پر عدد نہیں ہوتا ہے۔
جوہری تعداد کو جوہری ماس سے جمع کریں۔ چونکہ کسی ایٹم کے بڑے پیمانے پر اس کے پروٹان اور نیوٹرلز میں پایا جاتا ہے ، لہذا ایٹم ماس سے پروٹانوں کی تعداد (یعنی جوہری تعداد) کو گھٹانا آپ کو نمبر دے گا حساب کتاب ایٹم میں نیوٹران کی اعشاریہ عدد کے بعد کی تعداد عام طور پر ایٹم میں الیکٹرانوں کے بہت چھوٹے بڑے پیمانے کی نمائندگی کرتی ہے۔ ہماری مثال میں ، یہ ہے: 190 (ایٹم ماس) - 76 (پروٹون کی تعداد) = 114 (نیوٹران کی تعداد)۔
فارمولا یاد رکھیں۔ مستقبل میں نیوٹران کی تعداد معلوم کرنے کے لئے ، صرف یہ فارمولا استعمال کریں: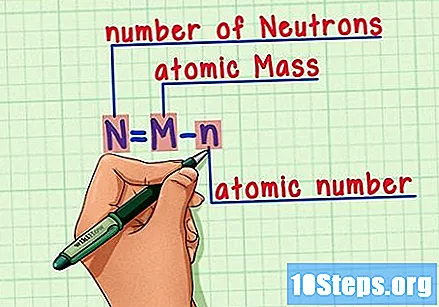
- N = M - n.
- N = کی تعداد اینیوٹران
- ایم = ایمجوہری روسٹ
- n = nجوہری ہومرس
- N = M - n.
طریقہ 2 کا 2: آاسوٹوپ میں نیوٹران کی تعداد کا پتہ لگانا
متواتر ٹیبل میں عنصر کا پتہ لگائیں۔ مثال کے طور پر ، کاربن -14 آاسوٹوپ کا استعمال کریں۔ چونکہ کاربن -14 کی غیر آئسوٹوپک شکل محض کاربن (سی) ہے ، لہذا اس عنصر کو متواتر جدول میں ڈھونڈیں (دوسری قطار میں)۔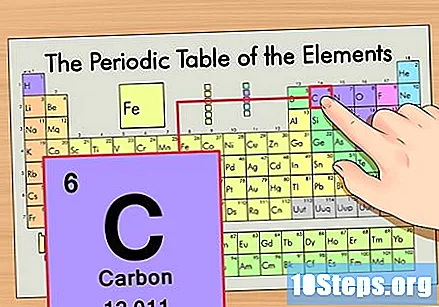
عنصر کی ایٹم نمبر تلاش کریں۔ یہ عام طور پر کسی خاص عنصر کے لئے سب سے زیادہ دکھائی دینے والی تعداد ہوتی ہے اور عام طور پر اس کی علامت سے بھی اوپر ہوتی ہے (اس جدول میں جس کا ہم استعمال کررہے ہیں ، در حقیقت ، کوئی دوسرا نمبر درج نہیں ہے)۔ جوہری تعداد اس عنصر کے ایک واحد ایٹم میں پروٹان کی تعداد ہوتی ہے. سی نمبر 6 ہے ، جس کا مطلب ہے کہ کاربن ایٹم میں 6 پروٹون ہوتے ہیں۔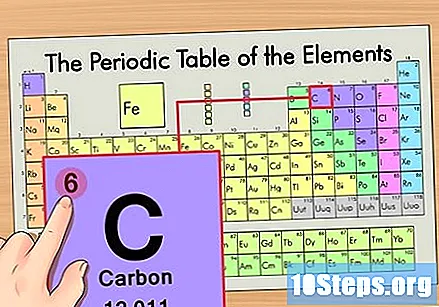
جوہری ماس تلاش کریں۔ آاسوٹوپس کے ساتھ یہ ناقابل یقین حد تک آسان ہے ، کیونکہ ان کا نام ان کے ایٹم ماس کے نام پر رکھا گیا ہے۔ کاربن -14 کا ایٹم ماس 14 ہوتا ہے۔ ایک بار جب آپ آاسوٹوپ کے جوہری بڑے پیمانے پر تلاش کرلیں تو ، نیوٹران کی تعداد تلاش کرنے کا عمل وہی ہوتا ہے جو عام جوہریوں کے لئے استعمال ہوتا ہے۔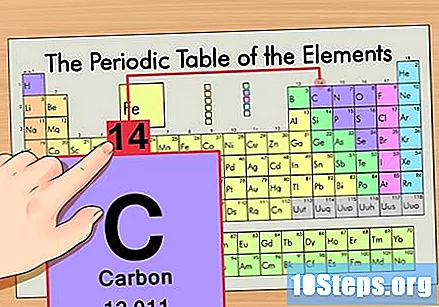
جوہری تعداد کو جوہری ماس سے جمع کریں۔ چونکہ کسی ایٹم کے بڑے پیمانے پر اس کے پروٹان اور نیوٹرلز میں پایا جاتا ہے ، لہذا ایٹم ماس سے پروٹانوں کی تعداد (یعنی جوہری تعداد) کو گھٹانا آپ کو نمبر دے گا حساب کتاب ایٹم میں نیوٹران کی اعشاریہ عدد کے بعد کی تعداد عام طور پر ایٹم میں الیکٹرانوں کے بہت چھوٹے بڑے پیمانے کی نمائندگی کرتی ہے۔ ہماری مثال میں ، یہ ہے: 14 (ایٹم ماس) - 6 (پروٹانوں کی تعداد) = 8 (نیوٹران کی تعداد)۔
فارمولا یاد رکھیں۔ مستقبل میں نیوٹران کی تعداد معلوم کرنے کے لئے ، صرف یہ فارمولا استعمال کریں: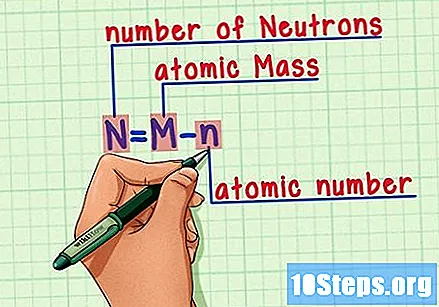
- N = M - n.
- N = کی تعداد اینیوٹران
- ایم = ایمجوہری روسٹ
- n = nجوہری ہومرس
- N = M - n.
اشارے
- کمرے کے درجہ حرارت پر مشتمل ٹھوس دھات آسیمیم ، اس کا نام یونانی زبان میں 'بو' ، 'اوسم' سے ماخوذ ہے۔
- پروٹان اور نیوٹران عناصر کا تقریبا entire پورا وزن رکھتے ہیں ، جبکہ الیکٹران اور دیگر متعدد ذرات ایک نہ ہونے کے برابر ماس کی نمائندگی کرتے ہیں (صفر ماس تک پہنچتے ہیں)۔ چونکہ ایک پروٹان اتنے ہی وزن کے برابر ہوتا ہے جتنا غیر جانبدار اور ایٹم نمبر پروٹون کی تعداد کی نمائندگی کرتا ہے ، لہذا ہم پروٹون کی تعداد کو کل ماس سے گھٹا سکتے ہیں۔
- اگر آپ کو یقین نہیں ہے کہ متواتر جدول میں کون سی تعداد ہے ، تو صرف یہ یاد رکھیں کہ یہ عام طور پر ایٹم نمبر (یعنی پروٹون کی تعداد) کے ارد گرد بنایا جاتا ہے ، جو 1 (ہائیڈروجن) سے شروع ہوتا ہے اور فی یونٹ اوپر جاتا ہے بائیں سے دائیں ، آخر میں 118 (یوناتسیٹو) میں اختتام پذیر۔ اس کی وجہ یہ ہے کہ ایٹم میں پروٹونوں کی تعداد یہ طے کرتی ہے کہ وہ کونسا ہے ، اس سے عنصری خصوصیت کو منظم کرنا آسان ہوجاتا ہے (مثال کے طور پر ، 2 پروٹانوں والا ایک ایٹم ہمیشہ ہیلیم ہی ہوگا ، جیسے ایک اور ایٹم 79 پروٹون ہمیشہ سونا ہوگا)۔